Apicomplexa
The Apicomplexa adalah kelompok monofiletik terdiri hampir seluruhnya dari parasit (yaitu, tidak ada yang hidup bebas) spesies. Apicomplexa, bersama dengan ciliates dan dinoflagellata, membentuk kelompok yang lebih tinggi dikenal sebagai Alveolata. Sebuah ciri khas utama dari kelompok ini rata struktur vesikel seperti - disebut alveolae kortikal - yang ditemukan hanya di bawah membran plasma. Sebelumnya Apicomplexa adalah bagian dari sporozoa kelompok yang disebut dan nama ini masih kadang-kadang digunakan. Ada beberapa saran untuk kembali ke nama sporozoa (Cox, Tr Parasitol 18:.. 108 ).
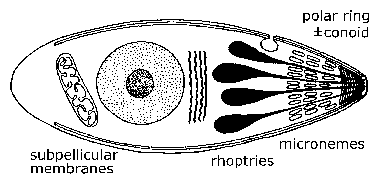
Mikroskop elektron mengungkapkan fitur ultrastructural unik di antara berbagai sporozoa yang kemudian digunakan untuk mendefinisikan kembali kelompok.Sebuah ciri khas dari Apicomplexa adalah sekelompok organel yang ditemukan di salah satu ujung - yang disebut akhir apikal - organisme. Ini 'apikal kompleks' termasuk organel sekretori dikenal sebagai micronemes dan rhoptries , cincin polar terdiri dari mikrotubulus, dan dalam beberapa spesies conoid yang terletak dalam cincin polar. Di beberapa titik selama siklus hidup mereka, anggota Apicomplexa baik menyerang atau melampirkan sel inang. Hal ini selama tahap invasif (dan / atau motil) ini bahwa organel apikal disajikan serta membran subpellicular, yang sebenarnya alveoli kortikal. Organel apikal berperan dalam interaksi parasit dengan sel inang dan invasi berikutnya dari sel inang. (Lihat pembahasan rinci tentang invasi sel inang oleh parasit malaria.) Bentuk motil dari merangkak Apicomplexa sepanjang substratum dalam mode non-ameboid dikenal sebagai meluncur motilitas. Banyak spesies apicomplexa telah flagellated gamet .
 |
 |
| Umum Struktur apicomplexa dan Siklus Hidup . Bentuk invasif dan / atau motil dari Apicomplexa pameran fitur ultra khas yang dapat dilihat dengan mikroskop elektron. Pada akhir sangat apikal adalah cincin mikrotubulus dikenal sebagai cincin polar. Kadang-kadang struktur cytoskeletal rumit yang dikenal sebagai conoid juga terlihat. Vesikel eliptical kecil yang dikenal sebagai micronemes juga terlihat di akhir ini serta air mata berbentuk tetes organel yang disebut rhoptries. | |
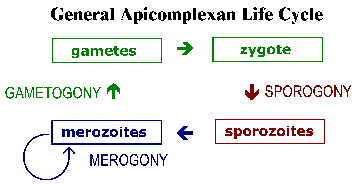
The Apicomplexa memiliki siklus hidup yang kompleks yang ditandai dengan tiga proses yang berbeda: sporogoni, merogony dan gametogony (Gambar). Meskipun sebagian besar Apicomplexa pameran siklus hidup keseluruhan umum ini rincian dapat bervariasi antara spesies. Selanjutnya, terminologi yang digunakan untuk menggambarkan berbagai tahap siklus hidup bervariasi antara spesies. Siklus hidup terdiri dari kedua bentuk reproduksi aseksual dan tahap seksual. Dalam spesies monoxenous ketiga proses ini akan dilakukan di sebuah host dan sering dalam jenis sel tunggal atau jaringan. Padahal, dalam spesies heteroxenous berbagai proses akan dilakukan di host yang berbeda dan umumnya melibatkan jaringan yang berbeda.
Sporogoni terjadi segera setelah fase seksual dan terdiri dari reproduksi aseksual yang memuncak dalam produksi sporozoit. Sporozoit merupakan bentuk invasif yang akan menyerang sel dan berkembang menjadi bentuk yang mengalami replikasi aseksual lain yang dikenal sebagai merogony. Merogony dan merozoit yang dihasilkan dikenal dengan banyak nama yang berbeda tergantung dari spesies. Berbeda dengan sporogoni, di mana ada umumnya hanya satu putaran replikasi, cukup sering ada beberapa putaran merogony. Dengan kata lain, merozoit, yang juga bentuk invasif, dapat reinvade sel dan memulai putaran lain merogony.Kadang-kadang beberapa putaran merogony akan melibatkan switch dalam organisme host atau switch dalam jenis sel diserang oleh parasit yang mengakibatkan tahap yang berbeda dari merogony. Sebagai alternatif untuk merozoit replikasi aseksual dapat berkembang menjadi gamet melalui proses bervariasi disebut gametogony, gamogony atau gametogenesis. Seperti pada jenis lain dari reproduksi seksual, gamet sekering untuk membentuk zigot yang akan menjalani sporogoni.
The Apicomplexa adalah sangat kelompok besar dan beragam (> 5000 bernama spesies). Tujuh spesies menginfeksi manusia (Box).Plasmodium , sebagai agen penyebab malaria, memiliki dampak terbesar pada kesehatan manusia. Babesia adalah infeksi zoonosis relatif jarang. Lima spesies lainnya yang diklasifikasikan sebagai coccidia. Namun, data molekuler baru-baru ini menunjukkan bahwaCryptosporidium terkait lebih erat dengan gregarines daripada coccidia tersebut. Coccidia yang umumnya dianggap patogen oportunistik dan sering dikaitkan dengan AIDS. Beberapa parasit apicomplexa juga penting dalam hal kedokteran hewan dan pertanian. Paling menonjol adalah Babesia dan Theileria pada sapi dan Eimeria pada unggas.
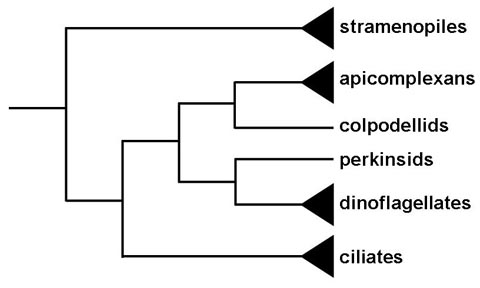
Alga Asal dari Apicomplexa |
|
Historis Apicomplexa telah digambarkan sebagai sebuah kelompok dengan hanya bentuk parasit. Ini dan organel apikal mereka yang unik memunculkan pertanyaan dalam hal asal-usul kelompok. Analisis filogenetik menunjukkan bahwa anggota atau genus Copodella membentuk kelompok saudara dengan Apicomplexa (1). The colpodellids adalah flagelata predator yang memakan alga uniseluler dengan proses yang disebut myzocytosis. Myzocytosis melibatkan predator (atau parasit) melekat mangsa (atau host) dan secara harfiah mengisap sitoplasma sel mangsanya melalui struktur khusus. Lampiran ini dan interaksi dengan sel mangsa dimediasi oleh organel serupa dengan yang Apicomplexa yang memanfaatkan untuk dipasang atau invasi sel inang. Dengan demikian evolusi Apicomplexa kemungkinan berkembang dari pemangsaan myzocytoic ini untuk myzocytoic parasitisme, seperti yang diperagakan oleh gregarines danCryptosporidium , untuk parasitisme intraseluler. Organisme myzocytoic lain dengan Apicomplexa seperti organel apikal termasuk Perkinsus , parasit tiram dan kerang, dan Parvilucifera , predator dari dinoflagellata. Perkinsids ini, bagaimanapun, membentuk kelompok saudara dengan dinoflagellata dan bukan Apicomplexa (Gambar). Hal ini menunjukkan bahwa nenek moyang dari dinoflagellata dan apicomplexa clades mungkin telah menyalahi predator dan bahwa organel apikal dipertahankan dalam clade apicomplexa, namun kalah di sebagian besar clade dinoflagellata.
Koneksi lainnya antara ganggang dan Apicomplexa yang merupakan sisa kloroplas, yang disebut apikoplas itu, ditemukan di sebagian besar apicomplexans (2). Apikoplas kemungkinan hasil dari endosimbiosis sekunder dari ganggang merah dan kemungkinan yang endosimbiotik peristiwa yang menimbulkan sama dengan plastida dinoflagellata. Apikoplas adalah non-fotosintetik namun pameran kegiatan yang berhubungan dengan biosintesis asam lemak tipe II, biosintesis isoprenoid, dan sintesis mungkin heme. Jalur ini pada dasarnya prokariotik dan mewakili target obat yang sangat baik. A Alveolata fotosintesis, Chromera velia , yang tampaknya menjadi awal percabangan apicomplexa juga telah diidentifikasi (3).
|
Coccidia
Coccidia yang ditandai dengan tahap ookista berdinding tebal yang biasanya dikeluarkan dengan tinja. Beberapa coccidia ( Cryptosporidium, Cyclospora, Isospora ) melaksanakan seluruh siklus hidup mereka dalam sel epitel usus dari tuan rumah dan ditularkan melalui rute fecal-oral. Coccidia lainnya ( Sarcocystis, Toxoplasma ) memiliki siklus hidup yang lebih rumit yang melibatkan jaringan kista dan beberapa host (yaitu, heteroxenous).
Cryptosporidium
Sejak identifikasi awal tahun 1907 beberapa Cryptosporidium spesies telah diidentifikasi dalam berbagai hewan mulai dari ikan ke manusia. Kasus manusia pertama cryptosporidiosis dilaporkan pada tahun 1976 dan ditandai sebagai penyakit diare yang terkait dengan penekanan kekebalan. Awalnya diyakini menjadi penyakit langka dan eksotis. Selama tahun 1980-an Cryptosporidium diakui sebagai penyebab utama diare pada pasien AIDS dan sering mengakibatkan kematian. Namun, sekarang diakui bahwa Cryptosporidium merupakan penyebab umum dari diare pada orang imunokompeten dan mungkin telah patogen manusia sejak awal umat manusia. Dua spesies menginfeksi manusia telah diidentifikasi: C. parvum dan C. hominis .
SIKLUS HIDUP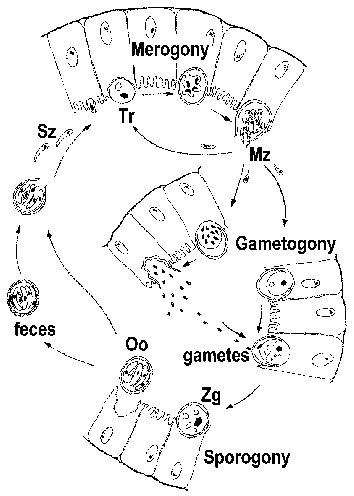
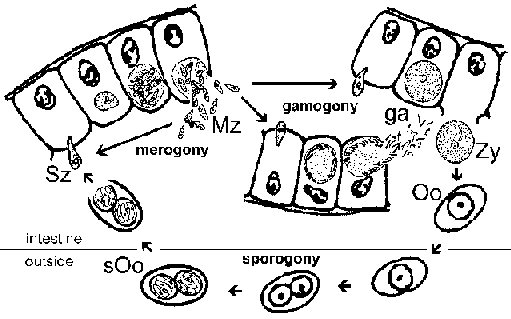
Cryptosporidium sering diklasifikasikan sebagai koksidia dan menunjukkan siklus hidup serupa dengan coccidia usus lainnya. Namun, Cryptosporidium lebih erat terkait dengan gregarines dan ini tercermin dalam beberapa aspek dari siklus hidupnya. Infeksi tersebut diperoleh melalui konsumsi ookista berspora (Gambar). [ Lihat gambar yang lebih besar dari siklus hidup dengan legenda rinci .] Perubahan pH yang berhubungan dengan perjalanan melalui usus dan empedu dan cairan pankreas dalam usus kecil pemicu excystation. Sporozoit (Sz) muncul dari ookista dan menempel pada sel epitel usus. Berbeda dengan coccidia lainnya, Cryptosporidium sporozoit tidak menyerang enterosit.Sebaliknya mereka menginduksi fusi dan perluasan mikrovili mengakibatkan parasit menjadi dikelilingi oleh membran ganda asal tuan rumah. Sebuah persimpangan, yang disebut 'pengumpan organel' atau 'zona adhesi', bentuk antara parasit dan enterocyte tuan rumah. Parasit, sekarang disebut trofozoit (Tr), kemungkinan berasal nutrisi dari sel inang melalui persimpangan ini. (Untuk review pada proses 'invasi' melihat Borowski et al, 2008 ).
Trofozoit menjalani replikasi aseksual (yaitu, merogony) dan menghasilkan 4-8 merozoit (Mz) yang dilepaskan ke dalam lumen usus. Merozoit menginfeksi sel epitel usus baru dan menjalani putaran tambahan merogony. keparahan meningkat dari penyakit pada pasien immunocompromised adalah karena sebagian ketidakmampuan mereka untuk membatasi ini putaran tambahan merogony.
Sebagai alternatif untuk merogony, merozoit dapat berkembang menjadi baik makro atau microgametocytes mengikuti infeksi dari enterocyte. Mikrogametogenesis melibatkan beberapa putaran replikasi diikuti oleh rilis dari sejumlah mikrogamet ke dalam lumen usus. The mikrogamet pupuk makrogamet masih menempel pada sel epitel usus. zigot yang dihasilkan (ZG) mengalami sporogoni dan ookista berspora (Oo) diekskresikan dengan feses. Sebuah autoinfeksi juga mungkin dan ini juga dapat berkontribusi untuk peningkatan keparahan penyakit pada pasien immunocompromised.
TRANSMISI DAN MOLEKULER EPIDEMIOLOGI
Faktor risiko penularan untuk Cryptosporidium mirip dengan penyakit fecal-oral lainnya. Namun, wabah cryptosporidiosis ditularkan melalui air telah sangat terkenal. Yang paling terkenal adalah wabah di Milwaukee pada musim semi tahun 1993 di mana sekitar 400.000 orang mengembangkan gejala kriptosporidiosis (MacKenzie et al, New Eng J. Med 331:.. 161, 1994 ). Faktor-faktor yang berkontribusi terhadap peningkatan risiko Cryptosporidium wabah yang ditularkan melalui air adalah:
- ukuran kecil dari ookista
- berbagai kekhususan host dan pengembangan monoxenous
- asosiasi yang erat antara manusia dan hewan host
- sejumlah besar ookista diekskresikan (hingga 100 miliar per betis)
- dosis infektif yang rendah
- ookista yang kuat yang tahan terhadap klorin
- menular ookista berspora diekskresikan
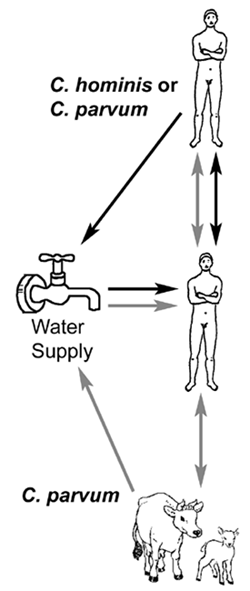
Meskipun kesan dari beberapa wabah yang ditularkan melalui air, penularan dari manusia ke manusia tampaknya mendominasi. Misalnya, anak-anak yang terinfeksi tanpa gejala yang umum, kasus sekunder di rumah tangga yang tinggi, dan wabah cenderung terjadi di rumah sakit, lembaga-lembaga dan pusat-pusat penitipan - situasi khas untuk transmisi fecal-oral . Studi molekuler telah mengungkapkan dua genotipe utama terisolasi dari manusia. Genotipe 1 hanya telah diisolasi dari sumber manusia dan non-infektif untuk tikus dan betis. Genotipe 2 telah diisolasi dari kedua hewan (sapi dan ovin) dan sumber daya manusia dan infektif untuk tikus dan betis. Berdasarkan ini dan perbedaan biologis lainnya telah diusulkan untuk mengubah nama genotipe 1 sebagai Cryptosporidium hominis (Morgan-Ryan et al, J. eUK Microbiol 49:.. 433, 2002 ). Spesies lain dan genotipe Cryptosporidium (misalnya,. C. felis telah diisolasi dari pasien AIDS dan jarang dari manusia imunokompeten (Morgan et al, J. Clin Microbiol 38..: 1180, 2000), genotipe seperti anjing, dll). Sebuah spesies ketiga dari anak benua India, C. viatorum , juga telah diusulkan (Elwin et al, Int J. Parasitol 42:.. 675, 2012 ).
Data genetik menyiratkan bahwa ada dua siklus transmisi yang berbeda pada manusia melibatkan dua populasi yang berbeda dari Cryptosporidium : 1) secara eksklusif anthroponotic (yaitu, manusia-ke-manusia) siklus disebabkan oleh genotipe 1 (atau C. hominis ) dan 2) siklus zoonosis disebabkan oleh genotipe 2 (atau C. parvum ). Siklus zoonosis awalnya akan melibatkan transmisi dari hewan (misalnya, sapi atau domba) untuk manusia dan kemudian kemudian manusia ke manusia transmisi dan mungkin penularan dari manusia ke hewan. Kedua genotipe telah terbukti menjadi agen etiologi dalam wabah waterbourne. Wabah yang ditularkan melalui air terkait dengan C. hominis mungkin karena kontaminasi air dengan pembuangan kotoran manusia, sedangkan wabah yang ditularkan melalui air yang terkait dengan C. parvum (genotipe 2) kemungkinan karena kontaminasi air dengan sapi atau domba kotoran.
PATOGENESISDARI
Manifestasi klinis yang paling umum dari kriptosporidiosis adalah ringan sampai Diare cair. diare ini umumnya membatasi diri dan tetap dari beberapa hari hingga satu bulan. Recrudescences yang umum. kram perut, anoreksia, mual, kehilangan berat badan dan muntah adalah manifestasi tambahan yang mungkin terjadi selama tahap akut. Penyakit ini bisa jauh lebih parah bagi penyandang AIDS yang memanifestasikan sebagai diare kronis yang berlangsung selama berbulan-bulan atau bahkan bertahun-tahun. Beberapa pasien AIDS menunjukkan penyakit kolera seperti fulminan yang memerlukan terapi rehidrasi intravena. Tingkat kematian bisa sangat tinggi dalam kasus-kasus fulminan.
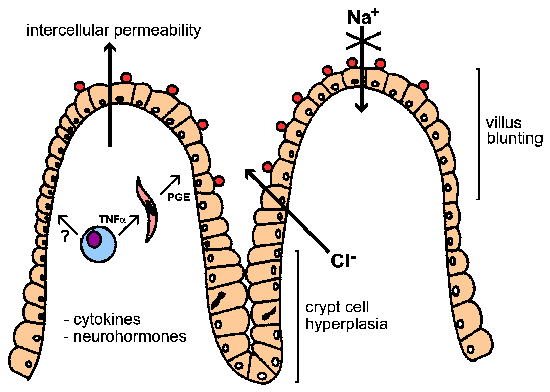
Diare dapat memiliki osmotik, inflamasi, atau komponen sekretori (lihat Kotak). Sifat berair dari diare yang berhubungan dengan Cryptosporidium infeksi telah menyarankan adanya enterotoksin. Namun, tidak ada bukti untuk diare sekretorik toksin-dimediasi meskipun upaya untuk mengidentifikasi racun tersebut. Bukti eksperimental tidak menunjukkan bahwa glukosa-ditambah Na + penyerapan menurun dan Cl - sekresi meningkat. Oleh karena itu, diare yang berhubungan dengan Cryptosporidium tampaknya terutama osmotik di alam (lihat Gambar). Terkait dengan gangguan ini enterocyte (yaitu, sel-sel epitel usus) fungsi adalah menumpulkan vili dan hiperplasia sel crypt. Mekanisme kemungkinan patogenesis adalah bahwa infeksi sel epitel usus denganCryptosporidium kerusakan enterosit dan akhirnya menyebabkan kematian mereka. Hal ini memicu pembelahan sel di daerah crypt (yaitu, hiperplasia) untuk menggantikan sel yang rusak. Kombinasi penghancuran sel absorbtive di ujung vili dan peningkatan Cl - -secreting crypt mengarah ke sekresi ditingkatkan secara keseluruhan.
|
|
Selain itu, peningkatan permeabilitas antar dan peradangan di lapisan submukosa (alias, lamina propria) telah dikaitkan dengan Cryptosporidium infeksi. Fenomena ini juga bisa berkontribusi pada proses sekresi melalui sitokin dan hormon-saraf. Misalnya, makrofag mensekresi tumor necrosis factor-alpha (TNF-α) atau sitokin lainnya dapat merangsang fibroblas dan sel-sel lain di lamina propria untuk mengeluarkan prostoglandins (PGE) dan produk lainnya (misalnya., Intermediet oksigen reaktif). Produk ini kemudian dapat mempromosikan sekresi dan mengganggu penyerapan.
Parasit pameran trophism untuk jejunum dan ileum pada orang imunokompeten, sedangkan infeksi yang lebih luas lagi pada pasien AIDS dan dapat termasuk perut, usus dua belas jari, usus besar dan saluran empedu. Kisaran anatomi yang lebih luas ini pada pasien AIDS adalah mungkin karena ketidakmampuan sistem kekebalan tubuh untuk mengontrol dan membatasi infeksi. Diperantarai sel kekebalan tampaknya menjadi komponen utama dari respon imun dalam menghilangkan infeksi yang dibuktikan dengan korelasi antara lebih rendah CD4 + T-sel dan risiko dan tingkat keparahan cryptosporidiosis. Interferon-gamma, interleukin-12, dan tumor necrosis factor-alpha yang terlibat dalam perlindungan terhadap Cryptosporidium infeksi.
REFERENSI TAMBAHAN
- Clark DP, Sears CL (1996) Patogenesis cryptosporidiosis. Parasitologi Hari 12: 221
- Guerrant RL (1997) Cryptosporidiosis: sebuah, ancaman yang sangat menular yang baru muncul. Emerg. Dalam F. Dis. 03:51
- Greg Hannahs, Cryptosporidium parvum : patogen yang muncul. http://biology.kenyon.edu/slonc/bio38/hannahs/crypto.htm
- NE Ramirez, LA Ward dan S Sreevatsan (2004) Sebuah tinjauan biologi dan epidemiologi dari kriptosporidiosis pada manusia dan hewan. Mikroba dan Infeksi 6, 773-785 .
- Rose JB, Huffman DE, Gennaccaro A (2002) Risiko dan pengendalian ditularkan melalui air cryptosporidiosis. Janin Microbiol. Wahyu 26: 113 .
- Sunnotel, O et al (2006) Cryptosporidium . Surat Terapan Mikrobiologi 43, 7-16 .
- Xiao L dan Ryan UM (2004) Cryptosporidiosis: update dalam epidemiologi molekuler. Pendapat saat ini di Penyakit Infeksi 17, 483-490 .
- Xiao, L. dan Feng, Y. (2008) Zoonosis cryptosporidiosis. Janin Imunologi & Medical Microbiology 52: 309-323 .
Isospora
Isospora belli diyakini menjadi spesies yang valid yang hanya menginfeksi manusia. Ini memiliki distribusi di seluruh dunia tapi lebih sering terjadi di daerah tropis dan daerah dengan sanitasi yang buruk. Infeksi sering tanpa gejala dan orang-orang dengan gejala cenderung membatasi diri dengan durasi beberapa minggu.Infeksi lebih umum dan gejala yang lebih parah pada pasien AIDS yang pada orang imunokompeten.
Siklus hidup . Infeksi tersebut diperoleh melalui konsumsi ookista berspora (SOO). Sporozoit (Sz) yang rilis pada lumen usus dan menyerang sel-sel epitel usus.Dalam sel-sel epitel parasit mengalami putaran merogony mengarah ke produksi merozoit (Mz). Merozoit ini merilis reinvade sel epitel usus dan dapat menjalani putaran tambahan merogony atau berkembang menjadi baik mikro atau macrogamonts. Mikrogamet (ga) akan menyuburkan makrogamet (ga) untuk membentuk zigot (Zy) yang berkembang menjadi ookista (Oo). Ookista belum menghasilkan berlalu dalam tinja dan pematangan menjadi ookista berspora menular terjadi di lingkungan. Tahap dikenali selama pematangan ini (yaitu, sporogoni) termasuk ookista dengan sporoblast tunggal, ookista dengan dua sporoblasts, dan ookista matang dengan dua sporokista, yang masing-masing berisi empat sporozoit. [Lihat pembahasan juga rinci dari Cryptosporidium siklus hidup .]
Gejala dan Patogenesis . Gejala yang berhubungan dengan I. belli infeksi termasuk diare, steatorrhea, sakit kepala, demam, sakit perut, mual, dehidrasi dan penurunan berat badan. Darah jarang hadir dalam tinja. Secara umum, gejala mirip dengan cryptosporidiosis. Penyakit ini sering membatasi diri. Namun, dapat menjadi kronis dengan ookista terdeteksi dalam tinja selama berbulan-bulan sampai bertahun-tahun dan recrudescences gejala. Penyakit ini cenderung lebih parah pada bayi dan anak-anak daripada orang dewasa. Patologi terkait dengan belli I. infeksi atrofi terutama vili, atau menumpulkan, dan crypt hiperplasia seperti yang biasa terlihat pada infeksi usus lainnya.
Diare pada pasien AIDS sering sangat berair dan dapat menyebabkan dehidrasi yang membutuhkan rawat inap. Demam dan penurunan berat badan juga umum ditemukan. Temuan umum lainnya di antara pasien AIDS adalah diare intermiten kronis yang berlangsung selama berbulan-bulan sampai bertahun-tahun. Yang dihasilkan berlebihan berat badan dan ketidakseimbangan elektrolit dapat menyebabkan pemborosan dan bahkan kematian. Ada juga beberapa laporan dari isosporiasis ekstraintestinal disebarluaskan pada pasien AIDS.
Lindsay, DS, Dubey, JP, Blagburn, BL (1997) Biologi Isospora spp. dari manusia, primata non-manusia, dan hewan domestik. Clin. Microbiol. Wahyu 10: 19-34 .
Cyclospora
Kasus manusia pertama Cyclospora cayetanensis dilaporkan pada tahun 1979. Ini pada awalnya disebut sebagai tubuh cyanobacteria-seperti atau badan koksidia-seperti (CLB). Organisme dikonfirmasi untuk menjadi parasit koksidia dengan struktur ookista mirip dengan genus Cyclospora dan kemudian diberi nama pada tahun 1994 setelah Universidad Peruana Cayetano Heredia di Peru di mana sebagian besar studi awal telah dilakukan. Studi molekuler menunjukkan hubungan dekat dengan Eimeria, parasit hewan penting dari unggas dan ternak lainnya. C. cayetanenis memiliki distribusi di seluruh dunia, tetapi tampaknya menjadi sangat lazim di Amerika Latin, anak benua India, dan Asia Tenggara. Di negara-negara maju infeksi biasanya berhubungan dengan baik wabah bawaan makanan atau diare pelancong.
Siklus hidup dan transmisi . Siklus hidup Cylcospora mirip dengan Isospora ( lihat di atas ). Infeksi tersebut diperoleh melalui konsumsi ookista. Sprorozoites dilepaskan dan menginfeksi sel-sel epitel dari usus kecil bagian atas. Parasit mengalami merogony dan merozoit reinfect enterosit dan beberapa putaran lebih dari merogony dapat terjadi. Beberapa merozoit menjalani perkembangan seksual yang mengakibatkan produksi mikro dan makrogamet. Pemupukan dari makrogamet oleh Mikrogamet inisiat sporogoni dan pembentukan ookista. Seperti Isospora , sporulasi selesai di lingkungan dan belum dewasa ookista non-infeksi diekskresikan dalam tinja. Pematangan ookista untuk ookista menular berspora mungkin mengambil hari untuk minggu. Selain itu, struktur Cyclospora ookista adalah berbeda dari Isospora . Ookista ini berisi dua sporokista yang masing-masing berisi dua sporozoit.
Beberapa wabah di Amerika Serikat dan Kanada telah dikaitkan dengan produk segar yang diimpor dari Amerika Selatan dan Tengah (Tabel). Secara khusus, buah dan sayuran berdaun telah diidentifikasi sebagai item yang terkontaminasi kemungkinan. Ini adalah makanan yang biasanya dimakan mentah dan hanya dibilas.Tidak ada wabah telah dikaitkan dengan beku, olahan, atau dikupas buah atau sayuran. Sebuah musiman di wabah juga telah diamati dengan sebagian besar kasus terjadi pada musim semi dan awal musim panas. Sebuah musim yang sama telah diamati di negara-negara endemik juga. Berbeda dengan Amerika Serikat dan Kanada, di mana transmisi bawaan makanan mendominasi, sebagian besar kasus di Eropa dan Australia telah dikaitkan dengan perjalanan ke negara-negara endemik.
Dipilih siklosporiasis Wabah di Amerika Serikat dan Kanada |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Sebagai hasil dari tingginya jumlah wabah terkait dengan raspberry dari Guatemala Amerika Serikat membatasi impor raspberry dan diperlukan pemeriksaan peternakan. Hal ini mengakibatkan penurunan berikutnya dalam jumlah wabah di Amerika Serikat. Kanada, yang tidak membatasi impor, tidak mengalami penurunan jumlah wabah selama periode ini. kasus terkontrol penelitian selanjutnya dilakukan di Guatemala mengungkapkan bahwa infeksi yang paling umum pada anak-anak dengan memuncak prevalensi pada bulan Juni. Faktor risiko utama yang terkait dengan infeksi minum air yang tidak diobati. Di Peru kontak dengan tanah diidentifikasi sebagai faktor risiko lain, terutama di kalangan anak-anak berusia kurang dari dua tahun. pengolahan air yang tidak memadai di negara-negara endemik dapat menyebabkan kontaminasi air tanah dan dengan demikian mempertahankan siklus penularan. Agaknya transmisi bawaan makanan disebabkan irigasi atau pemberian pupuk dengan air yang terkontaminasi atau mencuci dan pengolahan makanan dengan air diperlakukan buruk.
Gejala . Cyclospora terutama menginfeksi sel-sel epitel di bagian atas dari usus kecil. Masa inkubasi umumnya satu-dua minggu. Gejala mirip dengan gastroenteritis yang disebabkan oleh Isospora dan Cryptosporidium yang biasanya mencakup siklus diare berair dan periode remisi jelas. Diare ditandai dengan sering buang air dan dapat bertahan sampai enam minggu, tetapi pada umumnya membatasi diri pada orang immunocompent. Anoreksia, malaise, mual dan kram gejala sering lain yang terkait dengan siklosporiasis. Dalam beberapa kasus pasien mungkin mengalami muntah, nyeri otot, penurunan berat badan yang cukup besar, dan diare peledak. Sebelumnya paparan Cyclospora muncul untuk memberikan beberapa perlawanan terhadap infeksi dengan berkurangnya gejala. Seiring waktu dewasa muncul untuk mengembangkan kekebalan dan pembawa asimtomatik dapat ditemukan di daerah endemis.
Seperti juga halnya untuk Cryptosporidium dan Isospora , diare yang disebabkan oleh Cyclospora pada pasien AIDS jauh lebih parah daripada pada orang imunokompeten. Diare dapat bertahan selama berbulan-bulan dan menghasilkan sindrom yang melemahkan dan mengancam kehidupan.
Ulasan Cyclospora:
Sterling dan Ortega (1999) Clycospora : teka-teki layak mengungkap. Emerg. Dalam F. Dis. 05:48 .
BL Herwaldt (2000) Cyclospora cayetanensis : Sebuah tinjauan berfokus pada wabah clyclosporiasis pada 1990-an. Clin. Dalam F. Dis. 31: 1040 .
JM Shields dan BH Olson (2003) Cyclospora cayetanensis: review dari koksidia parasit muncul. Jurnal Internasional untuk Parasitologi 33, 371-391 .
LS Mansfield dan AA Gajadhar (2004) Cyclospora cayetanensis , sebuah makanan-dan ditularkan melalui air koksidia parasit. Hewan Parasitologi 126: 73-90 .
YR Ortega dan R Sanchez (2010) Cyclospora cayetanensis , makanan-ditanggung dan ditularkan melalui air parasit. Clin. Microbiol. Wahyu 23: 218-234 .
Diagnosis dan Pengobatan usus Coccidia
Koksidiosis didiagnosis dengan menunjukkan ookista dalam tinja. Pewarnaan asam-cepat adalah metode yang disukai untuk coccidia yang noda merah cerah.Cryptosporidium, Cyclospora, dan Isospora dibedakan oleh ukuran dan struktur ookista (Tabel). Cyclospora dan Isospora tidak seragam mengambil noda mengakibatkan campuran dicemarkan, sebagian bernoda dan benar-benar bernoda ookista. Cyclospora dan Isospora juga dapat dideteksi melalui autofluorescence terkait dengan dinding kista. Karena ukurannya yang relatif besar, Isospora adalah mudah terdeteksi pada spesimen dicemarkan. Sarcocystis adalah infeksi manusia langka ( lihat di bawah ) dengan ookista mirip dengan Isospora kecuali bahwa sporokista umumnya dilepaskan dari ookista sementara masih dalam lumen usus.
| Parasit koksidia Ditemukan di Tinja Manusia | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Pengobatan yang disarankan untuk Cyclospora dan Isospora adalah kombinasi trimetoprim-sulfametoksazol (Bactrim). Tidak ada pengobatan sepenuhnya memuaskan untuk Cryptosporidium . Ini adalah hipotesis bahwa 'extracytoplasmic' lokasi Cryptosporidium penampungan dari obat. Paromomycin telah digunakan untuk pengobatan kriptosporidiosis, bagaimanapun, kemanjurannya diperdebatkan. Studi terkontrol menunjukkan bahwa paromomycin sederhana menekan parasitemia pada individu immunocompromised. Pengobatan Cryptosporidiosis parah harus mencakup perawatan suportif (rehidrasi dan dukungan gizi) dan agen anti-motilitas. Langkah-langkah pencegahan akan mirip dengan penyakit lain yang ditularkan melalui rute fecal-oral (lihat faktor risiko atau Giardia control ).
Kista jaringan Pembentukan Coccidia
Beberapa spesies koksidia menunjukkan siklus hidup heteroxenous di mana merogony berlangsung di jaringan host intermediate (mangsa) dan gametogony berlangsung di epitel usus dari tuan rumah definitif (predator). [Dengan konvensi, reproduksi seksual terjadi di host definitif.] Dalam hal infeksi manusia,Toxoplasma adalah kista jaringan umum membentuk parasit koksidia, sedangkan infeksi dengan Sarcocystis spesies yang cukup langka.
Siklus hidup (lihat Gambar) dari Sarcocystis dalam predator (yaitu, karnivora) mirip dengan siklus hidup coccidia usus, seperti Isospora , melibatkan siklus seksual (gametogony) dalam sel epitel usus. Satu perbedaan dalam Sarcocystis siklus hidup adalah kurangnya merogony dalam sel epitel usus. Dalam kata lain, merozoit diakuisisi oleh menelan mangsa yang terinfeksi hanya akan menghasilkan gamet setelah invasi sel epitel usus. Fusi gamet mengarah ke produksi ookista. Selain itu, sporokista biasanya dilepaskan dari ookista dalam usus dari tuan rumah dan karena itu menular sporokista ditemukan dalam tinja.
Intermediate host (herbivora) memperoleh infeksi dengan menelan sporokista berspora. Sporozoit dilepaskan, menyerang sel-sel epitel usus, dan menjalani merogony seperti khas coccidia usus. Berbeda dengan coccidia usus, merozoit akan menyerang sel-sel endotel dan menghasilkan infeksi sistemik. Cukup sering ada tropisme untuk jaringan tertentu seperti otak atau otot. The meronts (atau skizon) dalam jaringan ini sering sering dikemas dan disebut sebagai 'jaringan kista'.Kista jaringan ini, atau sarcocysts dalam kasus otot, sering menunjukkan tingkat yang lebih rendah dari replikasi selama merogony dan agak terbengkalai. Menelan hewan yang terinfeksi oleh karnivora akan melepaskan merozoit yang akan menyerang sel-sel epitheial usus dan dengan demikian menyelesaikan siklus hidup.
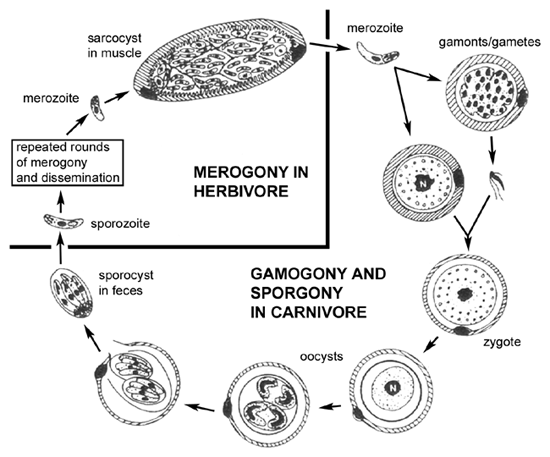
Siklus hidup predator-mangsa ini tidak bekerja sampai tahun 1970-an. Sebelumnya, infeksi usus di predator yang biasanya ditetapkan sebagai Isospora spesies dan infeksi jaringan di mangsa biasanya ditunjuk sebagai Sarcocystis spesies. Dalam banyak kasus host definitif belum diidentifikasi secara positif dan taksonomi banyakSarcocystis spesies tidak pasti.
Sarcocystis infeksi pada manusia telah didokumentasikan, tetapi jarang terjadi. Manusia adalah tuan rumah definitif untuk S. hominis (alias, S. bovihominis ) dan S. suihominis sebagaimana ditentukan oleh sumber infeksi menjadi, baik daging sapi atau babi masing-masing. Konsumsi daging sapi matang atau babi dari hewan yang terinfeksi akan menghasilkan infeksi enterik yang dapat menghasilkan gejala usus akut (perut ketidaknyamanan, mual, diare). Namun, sebagian besar infeksi diyakini tanpa gejala. Individu yang terinfeksi dapat menumpahkan sporokista dalam tinja selama berminggu-minggu untuk bulan setelah infeksi. Sporokista dari kotoran manusia yang infektif ke sapi, babi dan rusa.
Manusia juga dapat berfungsi sebagai tuan rumah menengah untuk setidaknya beberapa Sarcocystis spesies yang ditemukan di alam. Konsumsi dari sporokista oleh manusia dapat mengakibatkan tahap jaringan dari infeksi dan pembentukan sarcocysts. Sarcocysts ini umumnya beberapa 100 m dalam ukuran dan menyebabkan kerusakan jaringan kecil. Gejala klinis dapat meliputi nyeri otot atau episodik pembengkakan inflamasi menyakitkan. Kista otot ini pada manusia hanya telah sporadis dilaporkan (<100 kasus yang dilaporkan) dan mungkin mewakili infeksi disengaja. Satu studi mencatat bahwa sarcocysts pada manusia cenderung menyerupai Sarcocystis spesies yang umum ditemukan pada monyet lokal (Beaver et al, Am J. Trop Med Hyg 28:.... 819, 1979). Sebagian besar kasus telah dilaporkan dari Asia tropis dan subtropis, termasuk wabah sarcocystosis otot di antara wisatawan yang kembali dari Malaysia ( MMWR 61:37 ).
Fayer, R (2004) Sarcocystis spp. di Infeksi Human. Clin. Microbiol. Wahyu 17: 894-902 .
Toksoplasmosis
Toxoplasma gondii adalah parasit koksidia yang menginfeksi manusia serta berbagai macam mamalia dan burung. Ini menunjukkan siklus kehidupan jenis predator-mangsa (seperti yang dibahas di atas untuk Sarcocystis ) dan kucing adalah satu-satunya tuan rumah definitif. Toxoplasmosis ditemukan di seluruh dunia (kecuali iklim sangat dingin atau kering) dan cenderung lebih umum di iklim tropis. Studi serologi telah menunjukkan tingkat prevalensi hingga 70% pada usia 25 di beberapa populasi Amerika Tengah. Di Amerika Serikat diperkirakan 0,5-1% dari populasi menjadi terinfeksi setiap tahun dan prevalensi berkisar dari 10-25% pada usia 25. Toksoplasmosis adalah yang paling sering penyakit jinak. Pengecualian mencatat dalam kasus infeksi kongenital atau individu immunocompromised .
- Siklus hidup
- Fitur klinis
- Diagnosis , Pengobatan dan Pencegahan
Siklus hidup
Toxoplasma memiliki siklus hidup yang kompleks yang terdiri dari usus dan jaringan fase. Meskipun organisme pertama kali ditemukan pada tahun 1908 sebagai parasit jaringan dari gondi (suatu hewan pengerat Afrika), siklus hidup yang lengkap tidak tekun sampai 1970. Tahap usus infeksi hanya terjadi di kucing dan pameran siklus hidup koksidia usus khas yang terdiri dari merogony dan gamogony (lihat Isospora siklus hidup ). Kucing mendapatkan infeksi dengan makan hewan yang terinfeksi dengan tahap jaringan parasit. Parasit menyerang sel-sel epitel usus dan menjalani merogony. Merozoit yang dihasilkan kemudian dapat baik menjalani putaran tambahan merogony atau menjalani gametogony. Seperti mirip dengan Apicomplexa lainnya (lihat umum siklus hidup apicomplexa ) makro dan mikrogamet diproduksi. Dengan demikian, kucing dianggap sebagai tuan rumah definitif karena ini adalah tuan rumah di mana siklus seksual terjadi.
The mikrogamet bi-flagellated dilepaskan ke dalam lumen usus dan menyuburkan makrogamet dalam sel inang epitel. Sekresi dinding ookista dimulai tak lama setelah pembuahan. Siklus seksual ini memuncak dalam produksi ookista yang diekskresikan dalam tinja. Ini ookista matang menjalani sporogoni pada suhu kamar menghasilkan ookista matang berisi dua sporokista, masing-masing dengan empat sporozoit. Sporulasi biasanya memerlukan waktu 1-4 hari dan ookista tetap infektif selama berbulan-bulan di tanah lembab yang teduh. Telah dihipotesiskan bahwa makrogamet dibuahi mungkin juga mampu membentuk ookista matang (Ferguson, Tr Parasitol 18:.. 351, 2002 ).
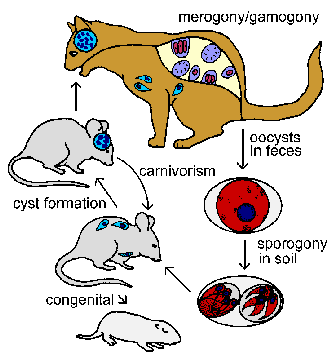 Menengah host, seperti tikus dan burung, menjadi terinfeksi melalui konsumsi ookista berspora. Sporozoit dilepaskan, menembus epitel usus, dan menyerang makrofag dan jenis sel. Proses invasi khas Apicomplexa dan parasit terletak dalam vakuola parasitophorous. Dalam vakuola parasit mengalami pembelahan biner (yaitu, merogony) dengan proses unik yang disebut endodyogeny. Endodyogeny adalah jenis khusus dari divisi di mana dua sel anak terbentuk di dalam sel induk.Bentuk-bentuk trofik disebut takizoit ( tachy berarti cepat) mengacu pada tingkat tinggi replikasi. Sel inang akan pecah dan melepaskan takizoit yang akan menyerang sel inang baru dan ulangi siklus replikasi. Makrofag yang terinfeksi akan menyebarkan takizoit seluruh host selama infeksi akut ini.
Menengah host, seperti tikus dan burung, menjadi terinfeksi melalui konsumsi ookista berspora. Sporozoit dilepaskan, menembus epitel usus, dan menyerang makrofag dan jenis sel. Proses invasi khas Apicomplexa dan parasit terletak dalam vakuola parasitophorous. Dalam vakuola parasit mengalami pembelahan biner (yaitu, merogony) dengan proses unik yang disebut endodyogeny. Endodyogeny adalah jenis khusus dari divisi di mana dua sel anak terbentuk di dalam sel induk.Bentuk-bentuk trofik disebut takizoit ( tachy berarti cepat) mengacu pada tingkat tinggi replikasi. Sel inang akan pecah dan melepaskan takizoit yang akan menyerang sel inang baru dan ulangi siklus replikasi. Makrofag yang terinfeksi akan menyebarkan takizoit seluruh host selama infeksi akut ini.
Sebagai tuan rumah mengembangkan kekebalan tingkat replikasi akan memperlambat dan sel inang yang terinfeksi akan menjadi dienkapsulasi (yaitu, jaringan kista). Bentuk-bentuk perlahan mereplikasi disebut bradyzoites ( brady berarti lambat) dan merupakan tahap tidur atau beristirahat. Bradyzoites dianggap metabolik diam, tapi tetap layak ( Dubey et al, Clin Microbiol Wahyu 11:.. 267, 1998 ). Perubahan lain yang terjadi ketika takizoit mengkonversi ke bradyzoites termasuk sekresi kitin dan komponen lainnya untuk membentuk dinding kista dan akumulasi butiran amilopektin (mencerminkan penyimpanan glukosa). Kista jaringan Toxoplasma menunjukkan berbagai ukuran, tetapi sering mendapatkan ukuran 50-70 m dengan diameter yang mengandung 1000-2000 bradyzoites. The bradyzoites terutama ditemukan di otak dan jaringan otot, sedangkan takizoit cenderung dalam sel retikuloendotelial.
Tahap bradyzoite merupakan infeksi kronis dan mungkin berlanjut untuk kehidupan tuan rumah. Mekanisme untuk ketekunan ini tidak diketahui. Beberapa peneliti percaya bahwa kista jaringan secara berkala memecah dan melepaskan bradyzoites yang akan menyerang sel inang baru dan menyebabkan pembentukan kista jaringan lebih.
Tahap jaringan infeksi juga dapat ditularkan kongenital kepada keturunannya dan host intermediate lain melalui carnivorism. Menelan hewan yang terinfeksi akan merilis bradyzoites dari jaringan kista yang kemudian menginfeksi sel-sel dalam host baru. Mungkin semua mamalia, termasuk manusia, dapat terinfeksitoksoplasma . Seperti dalam kasus tertular infeksi melalui konsumsi ookista, parasit akan melalui fase akut ditandai dengan replikasi cepat diikuti oleh fase kronis yang ditandai dengan jaringan kista aktif. Menelan hospes perantara yang terinfeksi oleh kucing akan memulai tahap usus dari siklus hidup yang melibatkan merogony dan gamogony dalam sel epithial usus. Kucing juga dapat mendukung tahap jaringan dari infeksi.
| Transmisi manusia |
|---|
|
Jelas manusia bukan merupakan bagian alami dari siklus hidup predator-mangsa dan mewakili tuan rumah disengaja yang tidak berpartisipasi dalam kelanjutan dari siklus penularan. Salah satu sumber infeksi adalah konsumsi bahan terkontaminasi dengan ookista berspora diekskresikan oleh kucing. Ini berarti beberapa asosiasi dengan kucing. Namun, karena ookista perlu jatuh tempo pada lingkungan sebelum menjadi menular, transmisi akan mencakup fitur transmisi tanah mirip dengan Isospora dan Cyclospora . Misalnya, anak-anak merangkak dan kotoran-makan usia diyakini berisiko lebih tinggi untuk infeksi. Ookista juga dapat diperoleh melalui kegiatan berkebun atau buah-buahan dicuci atau sayuran. Selain beberapa wabah yang terbawa air telah didokumentasikan. Tingginya prevalensi toksoplasmosis di Selatan dan Amerika Tengah diyakini karena tingginya tingkat pencemaran lingkungan dengan ookista. Ironisnya, kontak dengan anjing lebih dari faktor risiko untuk terinfeksi toksoplasma dari kontak dengan kucing. Hal ini mungkin karena anjing mencari kotoran kucing dan menjadi terkontaminasi dengan kotoran dan kemudian mentransfer ookista berspora untuk pakaian dan tangan pemiliknya. Menariknya, wabah yang ditularkan melalui air yang berhubungan dengan anak-anak kucing yang hidup di atas sebuah waduk air kota di Brazil dilaporkan (de Moura et al, 2006, Emerg Inf Dis 12:... 326 ).
Toksoplasmosis juga dapat diperoleh melalui konsumsi daging matang mengandung kista jaringan atau takizoit. Agaknya ternak memperoleh infeksi melalui merumput di daerah yang terkontaminasi dengan kotoran kucing. Kemampuan parasit untuk mentransfer antara host intermediate mungkin adaptasi evolusioner yang relatif baru dari parasit yang bertepatan dengan domestikasi kucing dan perluasan pertanian ( lihat Kotak ). Bahkan, sebagian besar infeksi di Amerika Serikat dan Eropa di antara orang dewasa mungkin diperoleh dari daging matang. Tingkat seropositif tinggi terutama di Perancis (hingga 90%) kemungkinan karena kecenderungan budaya untuk daging dimasak sebentar atau mentah. Kambing dan babi merupakan sumber lebih umum daripada daging sapi. Ada juga telah laporan terisolasi dari Toxoplasma sedang dikirim melalui takizoit dalam susu yang tidak dipasteurisasi kambing.
Toxoplasma juga dapat ditularkan dari ibu ke janin, seringkali dengan konsekuensi yang mengerikan ( lihat di bawah ). Transmisi kongenital hanya bisa terjadi selama infeksi akut (yaitu, takizoit) diperoleh selama pregancy. Ibu dengan infeksi kronis diperoleh sebelum kehamilan tidak pada risiko untuk transmisiToxoplasma . Tranmisi dari Toxoplasma sebagai akibat dari transplantasi organ juga mungkin. Jaringan kista dari donor organ yang terinfeksi kronis mungkin mengaktifkan kembali ketika ditransplantasikan ke penerima organ yang sebelumnya tidak terinfeksi. Selain itu, terapi imunosupresif juga bisa mengaktifkan infeksi laten di penerima. Akuisisi takizoit dari orang akut yang terinfeksi melalui transfusi darah juga mungkin. Transmisi dengan transplantasi atau transfusi sekarang jarang, meskipun.
| Analisis molekuler dari Toxoplasma isolat (terutama dari Amerika Utara dan Eropa) mengungkapkan keragaman genetik terbatas. Mayoritas (> 94%) dari isolat mengelompok menjadi tiga lineage klonal berbeda ditunjuk sebagai Tipe I, Tipe II dan Tipe III. Ketiga garis keturunan klonal yang erat terkait dan terdiri dari berbagai campuran dari dua alel pada lokus yang diuji.Ketiga jenis mungkin timbul dari rekombinasi genetik terjadi dalam 10.000 tahun terakhir (1). Ini akan menjadi bersamaan dengan perluasan pertanian manusia dan adaptasi dari kucing domestik.Dengan demikian, perubahan perilaku manusia mungkin telah menyebabkan pilihan dan cepat rambat Toxoplasma . Selanjutnya, ini jenis klon semua menunjukkan kemampuan untuk ditransmisikan melalui rute oral langsung antara host intermediate, yang mungkin belum fitur biologis dari Toxoplasma leluhur atau spesies lainnya yang berkerabat dekat seperti Neospora (lihat kotak di bawah ). Akuisisi ini dari infektivitas lisan langsung dikombinasikan dengan domestikasi hewan bisa mempromosikan cepat, dan terutama aseksual, perluasan Toxoplasma .
Ketiga Toxoplasma genotipe juga menunjukkan perbedaan dalam virulensi (2). Sebagai contoh, tipe I parasit sangat virulen pada tikus. Demikian pula, tipe I adalah tidak proporsional terkait dengan toksoplasmosis okular atipikal yang parah pada individu imunokompeten dan toksoplasmosis kongenital berat. Untungnya meskipun, infeksi tipe II cenderung mendominasi, terutama di Amerika Serikat Namun, ada beberapa bukti yang menunjukkan bahwa Toxoplasma menunjukkan keragaman di Amerika Selatan. Perbaikan dalam pengetahuan kita tentangToxoplasma biologi populasi dapat membantu menyelesaikan masalah ini dan mengakibatkan kontrol dan perlakuan yang lebih baik.
|
Fitur klinis
Toksoplasmosis pada orang dewasa dan anak-anak melewati tahap neonatal biasanya jinak dan tanpa gejala. Akuisisi infeksi baik melalui ookista atau hasil jaringan kista di infeksi akut yang takizoit disebarluaskan ke seluruh tubuh melalui sistem limfatik dan hematogen. Stadium akut ini akan bertahan selama beberapa minggu sebagai imunitas berkembang. Produksi antibodi membutuhkan 1-2 minggu dan imunitas seluler terjadi 2-4 minggu pasca infeksi. Kedua imunitas humoral dan selular yang penting, tapi respon seluler muncul penting untuk konversi dari akut (yaitu, takizoit) ke (yaitu, bradyzoites) infeksi kronis. (Lihat siklus hidup untuk penjelasan dari kecepatan dan bradyzoites.) Secara khusus, respon Th1 yang kuat ditandai dengan produksi sitokin proinflamasi termasuk interleukin-12, interferon-gamma, dan tumor necrosis factor-alpha berhubungan dengan Toxoplasma infeksi.
Ketika gejala memang terjadi mereka umumnya ringan dan biasanya digambarkan sebagai mononucleosis-seperti dengan menggigil, demam, sakit kepala, mialgia, kelelahan dan pembengkakan kelenjar getah bening. Gejala-gejala ini membatasi diri dan menyelesaikan dalam beberapa minggu ke bulan. Sebuah limfadenopati kronis tanpa demam bertahan atau berulang untuk sampai satu tahun juga telah tercatat sebagai gejala toksoplasmosis. Jarang individu imunokompeten menunjukkan gejala yang parah dan infeksi akut hampir selalu berkembang ke tahap kronis. infeksi laten ini mungkin berlanjut untuk kehidupan pasien tanpa menghasilkan apapun patologi progresif.
| toksoplasma Encecphalitis |
|---|
|
Toksoplasmosis telah lama tercatat sebagai infeksi oportunistik dalam hal reaktivasi infeksi laten karena imunosupresi yang terkait dengan transplantasi organ dan perawatan kanker tertentu. Selama tahun 1980-an ensefalitis toksoplasma muncul sebagai komplikasi umum yang terkait dengan AIDS. Diperkirakan 25-50% dari pasien AIDS dengan toksoplasmosis kronis akan mengembangkan ensefalitis. Reaktivasi infeksi biasanya terjadi ketika sel-sel CD4 turun di bawah 100 sel per mikroliter. Gejala awal ensefalitis toksoplasma bisa termasuk sakit kepala, demam, lesu, dan perubahan status mental dengan pengembangan menjadi fokal defisit neurologis dan kejang-kejang. Penyakit ini hampir selalu disebabkan oleh reaktivasi dari infeksi laten (lihat Kotak) dan cenderung tetap terbatas pada SSP. Dalam kata lain, jaringan kista yang pecah dan bradyzoites dirilis yang berubah menjadi takizoit. (Lihat siklus hidup untuk penjelasan dari kecepatan dan bradyzoites.) Lesi fokal disebabkan oleh penghancuran sel inang di sekitar langsung. Bentuk lain dari penyakit diaktifkan kembali, terutama retinochoroiditis, pneumonitis, miokarditis dan myositis, mungkin kadang-kadang terjadi dalam hubungannya dengan imunosupresi.
Carlos S. Subauste, Toxoplasmosis dan AIDS .
| Infeksi kongenital Hasil | ||||||||
|---|---|---|---|---|---|---|---|---|
|
Toxoplasmosis kongenital
Toxoplasma juga dapat ditularkan kongenital (yaitu, plasenta) jika ibu memperoleh infeksi selama kehamilan. Kongenital (yaitu, transplasenta) infeksi lebih mungkin menjadi gejala dari infeksi postnatal dan dapat menjadi parah (lihat Hasil Box).Beberapa fitur yang menonjol adalah:
- transmisi hanya mungkin selama tahap akut (yaitu, infeksi primer harus terjadi selama kehamilan)
- hanya dapat terjadi sekali
- sepertiga dari ibu seroconverting selama kehamilan akan menularkan infeksi ke janin
- Insiden antara 1 per 1000 dan 1 per 10.000 kelahiran hidup
- keparahan bervariasi dengan usia janin (lebih berat di awal kehamilan)
- transmisi lebih sering kemudian dalam kehamilan
- Infeksi dapat mengakibatkan: aborsi spontan, kelahiran prematur, atau jangka penuh dengan atau tanpa penyakit progresif
- Manifestasi penyakit khas meliputi: retinochoroiditis, kalsifikasi intraserebral, hidrosefalus, mikrosefali, gangguan psikomotor, keterbelakangan mental, kebutaan dan cacat visual lainnya
Okular Toksoplasmosis
Sebuah retinochoroiditis, radang retina dan koroid (area vaskular tebal di belakang mata), adalah manifestasi klinis lain dari Toxoplasma infeksi. Retinochoroiditiis dapat hasil dari infeksi kongenital atau dari infeksi akut atau diaktifkan kembali diperoleh postnatal. Awalnya manifestasi okular lebih sering dikaitkan dengan infeksi kongenital atau manifestasi terlambat karena reaktivasi dari infeksi kongenital. Namun, toksoplasmosis okular sedang dilaporkan dengan meningkatnya frekuensi dalam hubungan dengan infeksi akut. Ia telah mengemukakan bahwa genotipe yang berbeda menunjukkan berbagai tingkat virulensi terutama dalam hal ekspresi penyakit mata. Dalam kasus infeksi kongenital, retinochoroiditis dapat mengembangkan minggu untuk tahun setelah kelahiran. Sekitar dua puluh persen orang dengan infeksi kongenital akan menunjukkan retinochoroiditis saat lahir dan oleh remaja 82% akan menunjukkan gejala.
Lesi fokal di alam dan umumnya sembuh sendiri. Mereka diyakini sebagai akibat pecahnya kista di retina dalam kasus diaktifkan atau takizoit dalam kasus-kasus akut. Sel-sel retina sangat mirip dengan sistem saraf pusat. lesi granulomatosa juga dapat hadir di koroid. Lesi biasanya bilateral pada infeksi kongenital dan unilateral jika diperoleh postnatal. Penelitian pada hewan memberikan bukti bahwa nekrosis retina berhubungan dengan lesi disebabkan proliferasi parasit, sedangkan respon hipersensitivitas terhadap antigen toksoplasma bertanggung jawab untuk peradangan yang menyertainya. Gejalanya bisa berupa penglihatan kabur atau cacat visual lainnya. Visi dapat meningkatkan dengan resolusi peradangan. Kekambuhan penyakit telah dicatat, tetapi frekuensi dan faktor-faktor yang mempengaruhi kekambuhan tidak jelas. Penyakit ini jarang progresif pada individu imunokompeten, tetapi dapat bekas luka retina. Namun, penyakit ini bisa sangat parah pada pasien AIDS dan terus maju.
- GN Holland (2003) Ocular toksoplasmosis: penilaian ulang global yang: bagian I: epidemiologi dan perjalanan penyakit. American Journal of Ophthalmology 136, 973-988 .
- GN Holland (2004) toksoplasmosis okuler: penilaian ulang global yang: bagian II: Manifestasi penyakit dan manajemen. American Journal of Ophthalmology 137, 1-17 .
Diagnosis, Pengobatan dan Pencegahan
Berbeda dengan kebanyakan infeksi protozoa lainnya, diagnosis jarang dilakukan melalui deteksi atau pemulihan organisme, tetapi sangat bergantung pada prosedur serologi. Parasit dapat dideteksi pada spesimen dibiopsi, sel mantel buffy, atau cairan tulang belakang otak. Namun, mendeteksi takizoit dari bahan-bahan ini mungkin sulit. Spesimen ini juga dapat digunakan untuk tikus diinokulasi atau sel kultur jaringan atau dianalisis dengan PCR. Hasilnya bisa menyesatkan meskipun, karena banyak orang telah terkena toksoplasma dan kista jaringan pelabuhan (bradyzoites). Oleh karena itu, tes serologi merupakan komponen yang direkomendasikan diagnosis.
Diagnosis serologi Toxoplasma juga kompleks karena prevalensi individu sero-positif. Titer antibodi yang tinggi sendiri tidak bukti definitif infeksi akut. Infeksi kongenital yang sama sulit untuk mendiagnosa serologis karena IgG ibu melewati plasenta dan berlangsung selama beberapa bulan. Bukti infeksi akut titer IgM tinggi dan / atau peningkatan yang signifikan dalam jumlah titer antibodi dalam hubungannya dengan gejala. Teknik pencitraan (CT, MRI) juga mungkin berguna dalam diagnosis ensefalitis toksoplasma.
Indikasi pengobatan dan durasi :
- Gejala pasien harus dirawat sampai manifestasi telah surut dan ada bukti imunitas yang diperoleh.
- Pasien retinochoroiditis harus suplemen dengan kortikosteroid untuk menekan peradangan.
- Wanita hamil harus diperlakukan dengan spiramisin untuk mencegah infeksi janin.
- Neonatus harus dirawat selama 12 bulan untuk menghindari kejadian kemudian retinochoroiditis.
- Pasien immunocompromised harus diperlakukan. Terapi harus terus selama 4-6 minggu setelah penghentian gejala, diikuti oleh profilaksis selama imunosupresi berlangsung.
Pengobatan yang direkomendasikan adalah kombinasi sinergis dari pirimetamin ditambah sulfadiazin suplemen dengan asam folinic (Leucovorin®).
| Pencegahan |
|---|
daging mentah
|
Prognosis untuk toksoplasmosis akut pada orang dewasa imunokompeten sangat baik. infeksi akut pada janin atau anak-anak dapat diikuti dengan serangan berulang dari retinochoroiditis. Pengobatan tidak muncul untuk mengurangi frekuensi serangan ini.Jika mulai awal cukup, pengobatan pasien imunosupresi biasanya menghasilkan perbaikan, tetapi recrudescences yang umum.
langkah-langkah pengendalian untuk toksoplasmosis fokus pada menghindari dua sumber utama infeksi: daging mentah dan terkontaminasi kotoran kucing. kegiatan pencegahan (Kotak) meliputi: menghindari menelan ookista berspora atau kista jaringan, kerusakan bentuk infektif, dan mencegah infeksi hewan peliharaan (misalnya, pemanasan.). Pencegahan sangat penting selama kehamilan ketika konsekuensi dari infeksi yang paling parah.
Ulasan tentang Toxoplasma :
- Bab tentang Toxoplasma gondii oleh JP Dubey
- Mencoba et al (2000) Int. J. Parasitol. 30, 1217
- D. Hill, JP Dubey (2002) Toxoplasma gondii : transmisi, diagnosis dan pencegahan. Mikrobiologi Klinik dan Infeksi 8: 634-640.
- DE Hill, S Chirukandotha dan JP Dubey (2005) Biologi dan epidemiologi Toxoplasma gondii pada manusia dan hewan. Ulasan Animal Health Penelitian 6: 41-61 .
- JG Montoya dan O Liesenfeld (2004) Toksoplasmosis. The Lancet 363: 1965-1976 .
| Neospora caninum adalah terkait erat dengan Toxoplasma gondii dan pameran morfologi hampir identik. Seperti Toxoplasma , Neosporamenginfeksi banyak hewan domestik dan merupakan penyebab utama aborsi dan lahir mati pada sapi di seluruh dunia. Definitif Host anjing yang menunjukkan penyakit neuromuskular. Manusia tidak host. Anjing terinfeksi setelah menelan jaringan yang terinfeksi dari host intermediate. Oocyts Unsporulated adalah gudang di feses dan bersporulasi di lingkungan. Host intermediate memperoleh infeksi dengan menelan ookista berspora. Namun, tidak seperti Toxoplasma , menengah host tidak bisa memperoleh infeksi dengan menelan bentuk jaringan dari host intermediate lainnya. Infeksi dapat ditularkan kongenital dan parasit yang mudah dipelihara pada sapi dan anjing dengan penularan vertikal. Siklus sylvatic melibatkan rusa ekor putih dan coyote juga telah diidentifikasi (Rosypal dan Lindsay, Tr. Parasitol. 21, 349. 2005 ). |
Babesiosis
| Sejarah Catatan |
|---|
| Pada tahun 1893, Smith dan Kilborne melaporkan bahwa kutu tranmit B. bigemina, penyebab Texas demam sapi. Ini adalah demonstrasi pertama dari penyakit arthropoda menular dan mungkin mengilhami penemuan berikutnya dari penyakit vektor-menular lainnya seperti demam kuning dan malaria. |
Babesiosis adalah infeksi zoonosis yang jarang ditularkan oleh kutu. Agen etiologi, Babesia spesies, adalah parasit darah yang menginfeksi berbagai hewan liar dan domestik di seluruh dunia. Babesia dan Theileria membentuk kelompok yang disebut piroplasms, mengacu pada bentuk intraerythrocytic yang berbentuk buah pir di beberapa spesies. Piroplasms menyebabkan kerugian besar ternak di daerah endemik. Apakah telah berspekulasi bahwa wabah sapi bangsa Mesir dijelaskan dalam buku Alkitab Keluaran mungkin telah demam air merah yang disebabkan oleh B. bovis .
Kedua genera piroplasm biasanya dibedakan oleh kurangnya siklus praeritrosit di Babesia dan kurangnya transmisi transovarial di Theileria (lihat siklus hidup di bawah). Data molekuler menunjukkan bahwa Babesia dan Theileria spesies tidak membentuk kelompok monophylogenic masing. Secara khusus, banyak Babesia spesies, yang telah informal dikelompokkan sebagai 'kecil'Babesia , lebih terkait erat dengan Theileria . Konsisten dengan data molekuler ini, tak satu pun dari kecil Babesia-- kontras dengan 'besar' Babesia --appears untuk ditransmisikan transovarial di kutu, menunjukkan kebutuhan untuk beberapa re-evaluasi klasifikasi piroplasm. (Lihat G Uilenberg 2006, Babesia - Sebuah gambaran sejarah, Kedokteran Hewan Parasitologi 138, 3-10 .)
* Peromyscus leucopus (tikus putih kaki) dan Microtus pennsylvannicus , masing-masing. |
Banyak spesies Babesia telah dilaporkan menginfeksi manusia. Tiga spesies yang paling dominan menginfeksi manusia B. microti, B. duncani , dan B. divergens(Tabel). Infeksi dengan spesies lain baik telah didokumentasikan dengan buruk atau terbatas beberapa kasus terpisah. Kasus awal yang terkait dengan splenektomi atau kondisi immuno-kompromi lainnya. Namun, orang immuno-kompeten terinfeksi Babesia dan tidak menunjukkan gejala klinis telah dijelaskan. Selain survei serologis menunjukkan bahwa infeksi mungkin di bawah didiagnosis. Fokus terbesar dari infeksi manusia di AS telah sepanjang wilayah pesisir timur laut, sehingga menimbulkan nama Nantucket demam, dan midwest atas. Infeksi di Eropa tampaknya jarang kemudian di Amerika Serikat, tetapi lebih fatal. Sebagian besar infeksi ini telah dikaitkan dengan individu yang sering berhubungan dengan ternak.
Siklus hidup
Babesia menunjukkan siklus hidup apicomplexa khas ditandai dengan merogony, gametogony, dan sporogoni (Gambar). Infeksi ini diakuisisi oleh host vertebrata ketika sporozoit (Sp) yang ditransfer selama makan kutu. The sporozoit menyerang eritrosit memanfaatkan mekanisme invasi yang mirip dengan Apicomplexa lainnya. (Lihat pembahasan rinci tentang invasi sel inang oleh parasit malaria .) Berbeda dengan Plasmodium , membran vacuolar parasitophorous (PVM) hancur setelah invasi dan parasit berada dalam kontak langsung dengan sitoplasma tuan eritrosit. Trofozoit (Tr) bagi dengan pembelahan biner dan menghasilkan merozoit (Mz), yang terinfeksi eritrosit tambahan dan memulai kembali siklus replikasi. Pada beberapa spesies, tetrad sebuah, disebut sebagai salib Maltese, kadang-kadang diamati.
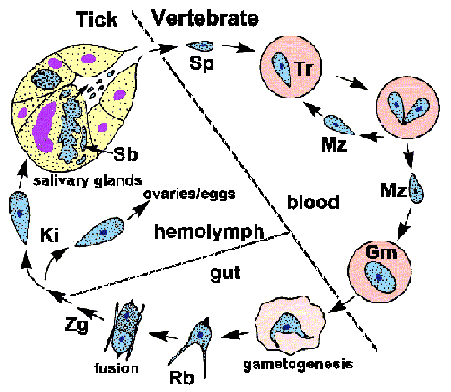
Beberapa trofozoit akan berkembang menjadi gametosit (Gm), atau gamonts, yang bertanggung jawab untuk memulai infeksi pada vektor kutu. Gametosit mengalami perubahan morfologi dalam usus kutu dan berkembang menjadi badan ray (Rb; alias Strahlenkörper). Dua mayat ray (yaitu, gamet) akan berfusi untuk membentuk zigot (ZG) yang kemudian berkembang menjadi kinete (Ki). Kinete menembus membran peritrofik dan epitel usus untuk mendapatkan akses ke hemolymph. Besar Babesia , seperti B. divergens dan B. canis , mampu menyerang berbagai organ dan menjalani replikasi lebih lanjut. Paling penting adalah invasi ovarium dan telur yang mengarah ke transmisi transovarial kepada keturunannya kutu ini.
Sporogoni dimulai ketika kinetes menyerang kelenjar ludah. parasit mengembang dan mengisi sel inang hipertrofi dan berkembang menjadi sporoblast berinti (Sb; alias sporont). sporozoit matang, memiliki organel apikal, akan tunas dari sporoblast terdiferensiasi ini ketika kutu feed lagi pada host baru. Lima-sepuluh ribu sporozoit dapat diproduksi oleh sporoblast tunggal. The sporozoit kemudian akan disuntikkan ke dalam host dengan air liur, sehingga menyelesaikan siklus hidup.
| Theileria spesies menginfeksi dan menyebabkan penyakit pada ternak, dan khususnya sapi, di banyak bagian dunia. Yang paling serius adalah demam East Coast sapi, yang disebabkan oleh T. parva . Ini memiliki 90-100 persen kematian di Afrika. T. annulata menyebabkan penyakit ringan ternak sepanjang Mediterania dan di Timur Tengah yang dikenal sebagai theileriosis tropis. Theileria terkait erat dengan Babesia dan menunjukkan siklus hidup yang sangat mirip (Gambar 16.1). Perbedaan utama adalah tahap pra-erythrocytic dipamerkan oleh Theileria spesies. Meskipun seperti tahap pra-erythrocytic dicurigai di B. microti . Sporozoit menyerang limfosit dan menginduksi proliferasi limfosit host dengan mekanisme yang tidak diketahui. Parasit berkembang menjadi skizon multinuklear (yaitu, meront) yang mengalami divisi bertepatan dengan replikasi dari limfosit berkembang biak, dan dengan demikian skizon ditransfer ke masing-masing limfosit putri. Merozoit yang dihasilkan menyerang eritrosit dan akhirnya berkembang menjadi gamonts yang menular untuk centang. Ini adalah proses limfoproliferatif yang mengarah ke manifestasi penyakit berat terkait dengan theilerioses. Transformasi limfosit ini reversibel dalam pengobatan yang mengarah ke parasit clearance dan proliferasi limfosit selanjutnya terhambat. |
Fitur klinis
Pada orang dengan limpa utuh infeksi umumnya diri terbatas dan ditandai dengan onset bertahap malaise, demam, sakit kepala, menggigil, berkeringat, mialgia, kelelahan dan kelemahan. Sebuah ringan sampai sedang anemia hemolitik juga dapat menyertai gejala-gejala tersebut. Banyak dari infeksi akan hilang dengan sendirinya tanpa pengobatan, tetapi parasit dapat bertahan selama berbulan-bulan. Penyakit ini cenderung lebih fulminan dan parah pada individu splenectomized atau imunosupresi dan dapat mengancam kehidupan. Parasitemias dari> 25% dan anemia berat dapat terjadi.
Tidak ada obat jelas efektif terhadap Babesiosis. Pengobatan yang dianjurkan adalah clindamycin + kina. Pentamidin juga telah ditunjukkan untuk menekan, namun tidak menghilangkan, parasitemia. Klorokuin, meskipun tidak tampak mempengaruhi parasitemia, tidak memberikan beberapa bantuan gejala, yang mungkin karena sifat anti-inflamasi. Atovakuon + azitromisin telah terbukti efektif sebagai klindamisin + kina, tetapi dengan sedikit merugikan mempengaruhi (Krause et al, 2000, N. Engl J. Med 343:. 1454). Transfusi tukar telah digunakan sebagai upaya menyelamatkan jiwa pada pasien sakit parah.
Meninjau di Babesiosis:
- Vannier E dan Krause PJ (2012) Manusia Babesiosis. NEJM 366: 23972407 .
LINK
- Puncak
- Manusia Apicomplexa menginfeksi
- Origins alga dari Apicomplexa
- Coccidia
- Toksoplasmosis
- Babesiosis
- Protozoologi Depan
- Kursus dan Kuliah lainnya
- Rumah bijaksana
- Situs Internet lainnya
Source: http://www.tulane.edu/~wiser/protozoology/notes/api.html